Makalah Teori VSEPR Dan Bentuk Bentuk Molekul
Makalah Teori VSEPR Dan Bentuk Bentuk Molekul
KATA PENGANTAR
Segala puji bagi Allah SWT yang telah menolong hamba-Nya menyelesaikan makalah Makalah Teori VSEPR Dan Bentuk Bentuk Molekul dengan penuh kemudahan. Tanpa pertolongan-Nya mungkin penyusun tidak akan sanggup menyelesaikan dengan baik.
Sholawat juga salam Allah semoga senantiasa tercurahkan kepada baginda Nabi Agung Muhammad SAW, semoga kita semua kelak mendapat syafaat beliau nabi.
Makalah ini disusun agar kami dan pembaca dapat mengetahui secara rinci tentang materi keterbagian khususnya pada sifat-sifat keterbagian.yang kami sajikan berdasarkan pengamatan dari berbagai sumber.
Makalah ini disusun oleh penyusun dengan berbagai rintangan. Baik itu yang datang dari diri penyusun maupun yang datang dari luar. Namun dengan penuh kesabaran dan terutama pertolongan dari Tuhan akhirnya makalah ini dapat terselesaikan.
Makalah ini memuat tentang bentuk-bentuk molekul. Dalam makalah ini juga diberikan beberapa cara peramalan bentuk-bentuk molekul .
Semoga makalah ini dapat memberikan wawasan yang lebih luas kepada pembaca dan dapat mengetahui secara rinci akan materi yang telah kami susun. Walaupun makalah ini memiliki kelebihan dan kekurangan. Penyusun mohon untuk saran dan kritiknya.
Terima kasih
penulis
BAB I
PENDAHULUAN
1.1 Latar Belakang
Pengertian Bentuk molekul adalah susunan tiga dimensi dari atom-atom dalam suatu molekul. Bentuk molekul mempengaruhi sifat-sifat fisis dan kimianya, seperti titik leleh, titik didih, kerapatan, dan jenis reaksi yang dialaminya. Secara umum panjang ikatan dan sudut ikatan harus ditentukan lewat percobaan. Tetapi terdapat cara sederhana yang memungkinkan kita untuk meramalkan bentuk molekul atau ion dengan tingkat keberhasilan yang cukup tinggi jika kita mengetahui jumlah elektron di sekitar atom pusat dalam struktur lewis-nya. Dasar pendekatan ini adalah asumsi bahwa pasangan di kulit valensi suatu atom saling bertolakan satu sama lain. Kulit valensi (valence shell) adalah kulit terluar yang ditempati elektron dalam suatu atom yang biasanya terlibat dalam suatu ikatan.
Dalam ikatan kovalen, yang sering disebut pasangan ikatan berperan dalam mengikat dua atom. Tetapi dalam molekul poliatomik, dimana terdapat dua atau lebih ikatan antara atom pusat dan atom disekitarnya, tolak-menolak antara elektron-elektron dalam pasangan ikatan yang berbeda menyebabkan pasangan itu berada sejauh mungkin satu sama lain.
Bentuk yang dipilih suatu molekul meminimalkan tolakan (seperti terlihat dari posisi seluruh atom). Pendekatan untuk kajian bentuk molekul ini disebut model tolakan pasangan – elektron kulit – valensi (TPEKV) (Valence – shell electron – pair repulsion, VSEPR), karena pendekatan ini menjelaskan susunan geometrik dari pasangan elektron disekitar atom pusat sebagai akibat tolak-menolak antara pasangan elektron.
Dengan model ini, kita dapat meramalkan bentuk molekul (dan ion) secara sistematis. Untuk tujuan ini, molekul-molekul dibagi ke dalam dua golongan, berdasarkan pada apakah atom pusatnya mengandung pasangan elektron bebas atau tidak.
1.2 Rumusan Masalah
- Teori VSEPR dalam meramalkan bentuk-bentuk molekul
- Langkah-langkah menentukan bentuk-bentuk molekul
- Bentuk-bentuk molekul
1.3 Tujuan
- Agar mengetahui teori VSEPR dalam meramalkan bentuk-bentuk molekul
- Agar mengetahui bentuk-bentuk molekul
- Agar mengetahui langkah-langkah dalam meramalkan bentuk-bentuk molekul
BAB II
PEMBAHASAN
2.1 Teori VSPER
Teori VSEPR (Valence Shell Electron Pair Repulsion: tolakan pasangan elektron kelopak valensi) adalah suatu model kimia yang digunakan untuk menjelaskan bentuk-bentuk molekul kimiawi berdasarkan gaya tolakan elektrostatik antar pasangan elektron. Teori ini juga dinamakan teori Gillespie-Nyholm, dinamai atas dua orang pengembang teori ini. Akronim "VSEPR" diucapkan sebagai "vesper" untuk kemudahan pengucapan.
Premis utama teori VSEPR adalah bahwa pasangan elektron valensi disekitar atom akan saling tolak menolak, sehingga susunan pasangan elektron tersebut akan mengadopsi susunan yang meminimalisasi gaya tolak menolak. Minimalisasi gaya tolakan antar pasangan elektron ini akan menentukan geometri molekul. Jumlah pasangan elektron di sekitar atom disebut sebagai bilangan sterik.
Teori VSEPR biasanya akan dibandingkan dengan teori ikatan valensi yang mengalamatkan bentuk molekul melalui orbital yang secara energetika dapat melakukan ikatan. Teori ikatan valensi berkutat pada pembentukan ikatan sigma dan pi. Teori orbital molekul adalah model lainnya yang digunakan untuk menjelaskan bagaimana atom dan elektron tersusun menjadi molekul dan ion poliatomik
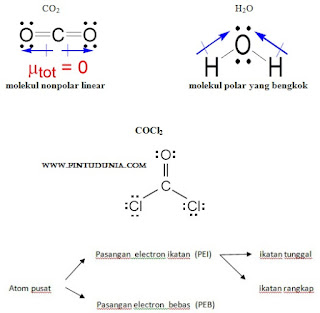
Symbol – symbol dalam teori VSEPR
A : Atom pusat
X : Jumlah pasangan electron ikatan
E : jumlah Pasangan electron bebas
Rumusan tipe molekul dapat ditulis dengan lambang AXnEm (jumlah pasangan electron)
Teori VSEPR menerangkan beberapa hal, diantaranya adalah sebagai berikut:
1. Pasangan-pasangan elektron pada kulit terluar atom pusat baik pasangan elektron bebas (PEB) maupun pasangan elektron terikat (PEI) akan tolak menolak satu sama lain sejauh mungkin sehingga gaya tolakannya menjadi minimum.
2. Kekuatan tolakan antar pasangan elektron berbeda-beda. Tolakan PEB-PEB > tolakan PEB-PEI > PEI-PEI. Hal ini terjadi karena PEB hanya terdapat pada satu atom saja, sehingga dapat bergerak bebas dan menempati ruang lebih besar dibandingkan PEI. Akibat dari tolakan dari PEB tersebut maka sudut ikatan PEI menjadi lebih kecil.
3. Teori ini tidak menggunakan orbital atom, yang penting kita mengetahui banyaknya pasangan elektron terluar di sekitar atom pusat, baik PEB maupun PEI dengan menggunakan struktur titik elektronnya (struktur lewis) kemudian menentukan posisi PEI untuk meramalkan geometri molekulnya.
Pasangan-pasangan elektron di sekitar atom pusat akan saling tolak-menolak jika berdekatan. Hal itu menyebabkan pasangan elektron akan berada pada kedudukan atau domain tertentu sehingga teori ini disebut teori domain elektron. Teori ini juga dikenal dengan nama Valence Shell Electron Pair Repultion Teory (VSEPR).
Berdasarkan teori ini, tolakan (PEB) lebih kuat dibandingkan tolakan PEI sehingga dapat ditentukan urutan kekuatan tolakan, yaitu kekuatan tolakan antara PEI vs PEU < PEI vs PEB < PEB vs PEB. Jika diketahui jumlah PEI dan PEB pada suatu molekul maka dapat diramalkan bentuk geometrinya berdasarkan kecenderungan setiap pasangan elektron menempati domainnya sebagai akibat tolakan antar pasangan elektron.
2.2 Bentuk Molekul Vsepr
a. Molekul dengan 2, 3, 4, 5, dan 6 pasangan PEI (tanpa PEB)
1) Senyawa dengan 2 PEI, yaitu BeCl2
Be bernomor atom 4 (1s22s2) memiliki elektron valensi 2. Pada senyawa BeCl2, kedua elektron valensinya membentuk 2 PEI dengan 2 atom Cl. Sesuai dengan teori domain elektron, kedua pasang PEI akan saling tolak menolak hingga pengaruh tolakan tersebut menjadi lemah. Itu menyebabkan pasangan PEI berada pada posisi yang terjauh, yaitu membentuk sudut sebesar 1800.
2) Senyawa BF3
Boron dengan nomor atom 5 (1s22s22p1) memiliki 3 elektron valensi. Ketiga elektron tersebut membentuk 3 PEI dengan atom F. tolak menolak ketiga PEI tersebut sama kuatnya sehingga ketiganya terdistribusi dengan sudut 1200 terhadap atom pusat B. keberadaan ketiga titik atom F tersebut dihubungkan sehingga berbentuk segitiga datar (trigonal planar
3) Senyawa CH4 Atom C yang memiliki 4 elektron valensi akan membentuk 4 PEI. Keempat elektron tersebut saling tolak menolak dengan kekuatan sama sehingga terdistribusi ke empat arah yang saling berjauhan membentuk 109,50 terhadap atom pusat C. bentuk molekul yang diperoleh adalah limas segitiga beraturan (tetrahedral).
4) Senyawa PCl5 Atom P yang memiliki konfigurasi elektron 1s22s22p63s23p3 dengan 5 elektron valensi sehingga membentuk 5 PEI dengan 5 atom klor. Pengaruh tolak menolak kelima PEI akan mendistribusikan 2 pasang elektron kea rah horizontal. Jadi, ada 2 sudut ikatan, yaitu sudut pada bidang datar sebesar 1200 dan sudut yang terbentuk pada arah vertical tegak lurus dengan bidang datar sebesar 900. Molekul yang terbentuk memiliki bangun (trigonal piramida).
5) Senyawa SF6 atom S memiliki 6 elektron valensi dapat membentuk 6 PEI dengan 6 elektron dari atom F. semua PEI tersebut akan terdistribusi merata membentuk sudut ikatan sebesar 900. Molekulnya berbentuk 8 bidang beraturan (octahedral)
b Molekul dengan 4 pasang elektron valensi
Misalnya NH3 dan H2O
Jumlah pasangan elektron valensi pada molekul NH3 sebanyak 4 pasang seperti CH4, tetapi sepasang diantaranya adalah PEB. Berdassarkan hasil pengukuran, bentuknya dapat diramalkan, yaitu limas segitiga (trigonal piramida).
Pada molekul H2O terdapat 4 pasang elektron yang terdiri dari 2 PEB dan 2 PEI. Akibat tolakan 2 PEB, sudut ikatan H-O-H sebesar 104,50, yaitu lebih kecil dibandingkan sudut ikatan H-N-H pada NH3. Bentuk molekulnya tidak seperti garis (linear), tetapi menyudut atau bengkok, seperti huruf V.
c. Molekul dengan 5 pasangan elektron
Contohnya : SF4, ICl3, XaF4
Jumlah elektron valensi dan pasangan elektron pada ketiga senyawa tersebut dapat dibuat tabel berikut ini:
Ramalan ketiga bentuk molekul tersebut bdapat dimulai dengan struktur trigonal bipiramida, seperti mPCl5. Kemudian diperhitungkan pengaruh PEB pada setiap molekul sehingga diperoleh geometri molekul sebagai berikut:
SF4 memiliki molekul persekutuan dua limas segitiga (trigonal bipiramida) dengan alas segitiga yang besarnya hanya sepertiga dari bentuk molekul PCl5. Sudut FSF akan sedikit lebih kecil dari 1200 karena adanya pengaruh sepasang elektron bebas yang tolakannya kuat.
Bentuk molekul ICl3 menyerupai huruf T. bentuk alternative lainnya adalah segitiga datar dengan kedua PEB berada pada posisi vertical. Hasil percobaan menunjukkan bahwa senyawa ICl3¬.
2.4 Langkah-langkah dalam meramalkan bentuk-bentuk molekul
Dalam meramalkan atau cara mengetahui bentuk bentuk molekul paling mudah adalah sebagai berikut:
- Hitung jumlah elektron valensi (elektron kulit terluar) dari atom pusat.
- Tambahkan dengan besarnya muatan jika spesi bermuatan negatif dan kurangi dengan besarnya muatan jika spesi bermuatan positip.
- Tambahkan dengan jumlah atom yang terikat.
- Bagi dengan dua; menghasilkan jumlah pasangan elektron.
- Tempatkan pasangan elektron sehingga mengelilingi atom pusat
- Jumlah pasangan elektron (d) dikurangi jumlah atom yang terikat adalah sama dengan pasangan elektron bebas.
- Pasangan-pasangan elektron disusun mengelilingi atom pusat sehingga tolak menolak antara pasangan-pasangan elektron ini seminimal mungkin.
Contoh bentuk molekul struktur lewis
Kemungkinan bentuk molekul dalam teori VSEPR
ketika terdapat dua pasang elektron di sekitar atom pusat, gaya tolak-menolak di antara keduanya akan menjadi minimal ketika keduanya berada pada posisi saling berseberangan. Oleh karena itu, atom pusat diprediksikan mengadopsi geometri linear. Jika terdapat tiga pasang elektron, maka gaya tolak-menolak diminimalkan dengan mengadopsi bentuk trigonal. Dengan cara yang sama, untuk empat pasang elektron, susunan geometri yang optimal adalah tetrahedral.
Selain menggunakan teori VSEPR, bentuk molekul juga dapat diramalkan melalui pembentukan orbital hibrida, yaitu orbital-orbital suatu atom yang diperoleh saat dua atau lebih orbital atom bersangkutan yang memiliki tingkat energi yang berbeda, bergabung membentuk orbital-orbital baru dengan tingkat energi sama (terjadi pada proses pembentukan ikatan kovalen).
Hibridisasi adalah proses penggabungan orbital-orbital atom (biasanya pada atom pusat) untuk mendapatkan orbital hibrida.
Sementara untuk menentukan bentuk molekul, kita dapat menggunakan teori VSEPR. Dengan demikian, teori hibridisasi merupakan bagian yang tidak terpisahkan dari teori VSEPR. Melalui kombinasi kedua teori tersebut, kita dapat mempelajari jenis dan jumlah orbital yang terlibat dalam pembentukan ikatan sekaligus meramalkan bentuk molekulnya
2.5 Aturan Teori Vsepr
- Dalam kaitannya dengan tolak menolak pasangan elektron, ikatan rangkap dua dan ikatan rangkap tiga dapat diperlakukan sebagai ikatan tunggal
- ika suatu molekul memiliki dua atau lebih struktur resonansi, maka model VSEPR dapat diterapkan pada setiap struktur tersebut
Dalam penyederhanaannya, atom pusat dan atom terikat dinotasikan dengan A dan B berturut-turut, sedangkan pasangan elektron bebas dinotasikan dengan U sehingga menghasilkan notasi umum VSEPR AbxUy.
Teori VSEPR mengasumsikan bahwa setiap atom akan mencapai bentuk dengan tolakan antar elektron yang ada dalam kulit terluar seminimal mungkin. Keberadaan pasangan elektron non-ikat akan sedikit mengubah situasi pembentukan geometri molekul senyawa.
Tiga tipe tolakan yang terjadi, adalah:
- Tolakan antara pasangan elektron ikat dengan pasangan elektron ikat
- Tolakan antara pasangan elektron ikat dengan pasangan elektron non-ikat
- Tolakan antara pasangan elektron non-ikat dengan pasangan elektron nonikat.
Jika elektron non-ikat menempati ruang yang lebih besar, menyebabkan gaya tolak antar elektron non-ikat menjadi relatif besar, gaya tolak antara pasangan elektron non-ikat dengan elektron ikat menjadi lebih kecil dan gaya tolak antar pasangan elektron ikat menjadi jauh lebih kecil.
Teori VSEPR digunakan untuk memprediksi bentuk molekul suatu senyawa dengan mempertimbangkan:
• jumlah atom yang terikat pada atom pusat
• jumlah pasangan elektron non-ikat,
• ikatan rangkap dua dan rangkap tiga.
2.6 Keterbatasan atau kekurangan Teori VSEPR
Seperti teori-teori yang lain, teori VSEPR juga memiliki kelemahan-kelemahan. Beberapa diantaranya sebagai berikut:
Banyak senyawa logam transisi strukturnya tidak dapat dijelaskan menggunakan teori VSEPR. Teori VSPER gagal meramalkan struktur NH3+. Berdasarkan teori VSEPR bentuk molekul NH3+ adalah trigonal bipiramidal dengan sudut ikatan lebih kecil dari 120° (sedut normal untuk atom dengan bilangan koordinasi 3) tetapi lebih besar dari 109,47° (sudut normal untuk atom bilangan koordiansi 4) karena terdapat satu elektron tidak berpasangan pada atom N.
Namun berdasarkan hasil eksperimen ternyata bentuk dari NH3+ adalah segitiga planar dengan sudut ikatan sebesar 120°. Hal ini disebabkan elektron bebas terdistribusi secara merata pada bagian depan belakang atom N
Struktur senyawa halida triatomik dengan logam golongan 2 tidaklah linear pada fase gas seperti yang diprediksi oleh teori VSEPR, melainkan berbentuk tekuk (sudut X-M-X : CaF2, 145°; SrF2, 120°; BaF2, 108°; SrCl2, 130°; BaCl2, 115°; BaBr2, 115°; BaI2, 105°).
Gillespie mengajukan bahwa ini disebabkan oleh interaksi ligan dengan elektron pada inti atom logam yang menyebabkan polarisasi atom, sehingga kelopak dalam atom tidaklah simetris berbentuk bola dan memengaruhi geometri molekul.
Teori VSEPR dapat digunakan untuk meramal bentuk molekul dari hidrida-hidrida unsur-unsur pada periode 3 dan 4 seperti H2S, H2Se, PH3, AsH3 dan SbH3, namun gagal meramal besar sudut ikatan yang ada.
Berdasarkan teori VSEPR H2S dan H2Se berbentuk huruf V dengan besar sudut ikatan H-E-H (E=S atau Se) sekitar 104,5°C seperti sudut ikatan H2O. Namun berdasarkan eksperimen diperoleh besar sudut H-E-H mendekati 90° walaupun berbentuk V.
Sedangkan bentuk molekul PH3, AsH3 dan SbH3 berdasarkan teori VSEPR berbentuk trigonal piramidal dengan sudut ikatan H-E-H (E = P, As atau Sb) sekitar 107,3° seperti sudut ikatan NH3. Namun berdasarkan eksperimen diperoleh bahwa besar sudut ikatan H-E-H m,endekati 90° walaupun berbentuk trigonal piramidal.
2.7 Bilangan sterik
Bilangan sterik (SN) didefinisikan sebagai penjumlahan atom yang terikat pada atom pusat dan jumlah pasangan elektron non-ikat.
Rumus Bilangan sterik:
SN = (S atom yang terikat pada atom pusat) + (S pasangan elektron non ikatan pada atom pusat)
Contoh dari bilangan sterik = BRO4
BAB III
PENUTUP
3.1 Kesimpulan
Adapun kesimpulan yang dapat ditarik dari makalah Teori VSEPR Dan Bentuk Bentuk Molekul adalah sebagai berikut:
A. Teori VSEPR (Valence Shell Electron Pair Repulsion: tolakan pasangan elektron kelopak valensi) adalah suatu model kimia yang digunakan untuk menjelaskan bentuk-bentuk molekul kimiawi berdasarkan gaya tolakan elektrostatik antar pasangan elektron.[1] Teori ini juga dinamakan teori Gillespie-Nyholm, dinamai atas dua orang pengembang teori ini. Akronim "VSEPR" diucapkan sebagai "vesper" untuk kemudahan pengucapan.
B. Dalam suatu molekul elektron-elektron tersebut saling tolak-menolak karena memiliki muatan yang sama. Untuk mengurangi gaya tolak tersebut atom-atom yang berikatan membentuk struktur ruang tertentu hingga tercapai gaya tolak yang minimum. Akibat yang ditimbulkan dari tolakan yang yang terjadi yaitu mengecilnya sudut ikatan dalam molekul.
Urutan gaya tolak dimulai dari gaya tolak yang terbesar yaitu sebagai berikut :
1. Gaya tolak antar sesama elektron bebas (PEB vs PEB).
2. Gaya tolak antara pasangan elektron bebas dengan elektron ikatan (PEB vs PEI).
3. Gaya tolak antar pasangan elektron ikatan (PEI vs PEI). c. Langkah-langkah yang digunakan untuk meramal struktur molekul tidak berbeda jauh dengan langkah-langkah yang digunakan untuk menggambar struktur Lewis suatu molekul atau ion poliatomik.
C. Langkah-langkah yang digunakan untuk meramal bentuk molekul sebagai berikut :
1. Menentukan atom pusat.
2. Tuliskan jumlah elektron valensi dari atom pusat.
3. Menentukan jumlah elektron valensi dari masing-masing substituen jika berupa atom.
4. Satu elektron dari substituen dipasangkan dengan satu elektron dari atom pusat sehingga membentuk pasangan elektron (pasangan elektron ikatan, PEI). Perlu diperhatikan bahwa, bahwa jumlah elektron atom pusat tidak selalu memenuhi kaidah oktet. Jika masih terdapat substituen dan masih terdapat elektron pada atom pusat, maka semuanya harus dipasangkan.
5. Jika semua susbtituen telah dipasangkan dengan elektron atom pusat dan masih terdapat elektron yang tidak berpasangan, maka elektron tersebut tetap ditulis pada atom pusat sebagai elektron bebas atau pasangan elektron bebas (PEB).
6. Jika berupa ion poliatomik, maka setelah semua substituen dipasangkan kurangi elektron jika ion bermuatan positif dan tambahkan elektron jika ion bermuatan positif.
7. Menentukan bentuk molekul serta memperkirakan besarnya sudut-sudut ikatan disekitar atom pusat dengan memperhatikan tolakan-tolakan yang terjadi agar diperoleh bentuk dengan tolakan yang minimum.
3.2 Saran
Karena keterbatasan ilmu dan referensi yang kami miliki, kami sarankan kepada pembaca semua untuk melengkapi referensi tentang Teori VSEPR Dan Bentuk Bentuk Molekul ini, semoga ke depan bisa lebih lengkap lagi.
Daftar Pustaka
Brady, James. E. 1999. Kimia Universitas Asas Dan Struktur Jilid 2. Jakarta : Binarupa Aksara.
Cotton dan Wilkinson. 2007. Kimia Anorganik Dasar. Jakarta: Universitas Indonesia (UI- press).
Saito, Taro. 1996. Buku Teks Online Kimia Anorganik. Jakarta : Iwanami Publishing Company.
Terimakasih telah membaca Makalah Teori VSEPR Dan Bentuk Bentuk Molekul, semoga makalah kimia ini bermanfaat bagi anda. Kontak admin pintu dunia untuk mendapatkan aneka makalah, artikel, contoh skripsi dan lain lain secara gratis di kontak Us web ini bagian bawah. Thanks